 MDR:n tavoitteena on selkeyttää Euroopan lääkinnällisten laitteiden markkinoita.
MDR:n tavoitteena on selkeyttää Euroopan lääkinnällisten laitteiden markkinoita.
Tässä blogisarjassa käsitellään lääkintälaiteasetusta (MDR) sekä sen vaikutusta lääkinnällisille laitteille tarkoitettujen ohjelmistojen kehittämiseen. Neljännessä (viimeisessä) osassa käsitellään lääkinnällisten laitteiden ohjelmistojen yleisiä turvallisuus- ja suorituskykyvaatimuksia sekä niiden elinkaariprosesseja.
Blogisarjan edelliset osat:
Osa 1 – Ohjelmiston määrittely ja luokittelu
Osa 2 – Vaatimustenmukaisuuden arviointi, ohjelmistomoduulit ja muutosten vaikutus
Osa 3 – Laatujärjestelmä (QMS)
Lääkinnällisen laitteen ohjelmistokehityksen muistilista (4/4)
Tärkeitä huomioitavia asioita yleisissä turvallisuus- ja suorituskykyvaatimuksissa ja ohjelmistojen elinkaariprosesseissa:
- Määritä tietoturvan ja tietoverkkoturvallisuuden vaatimukset
- Huomioi mobiilialustan erityispiirteet ohjelmiston käyttöympäristössä
- Varmista yhteentoimivuus ja yhteensopivuus muiden laitteiden tai tuotteiden kanssa
- Määritä vaatimukset ja huomioitavat asiat laitteille, jotka on tarkoitettu maallikoiden käyttöön
- Määritä, dokumentoi ja ylläpidä ISO 14971 standardin mukainen riskienhallinnanjärjestelmä
- Valvo toimintoihin, käytettävyyteen, suorituskykyyn ja turvallisuuteen liittyviä riskejä
- Tee ohjelmiston turvallisuusluokitus IEC 62304 -standardin mukaisesti
- Määritä ohjelmistokehitysprosessi ohjelmiston turvallisuusluokituksen perusteella
- Määritä ja toteuta suunnittelun katselmukset tai tarkastukset
- Määritä ja toteuta tehokas CAPA-prosessi
- Varmista jäljitettävyys koko ohjelmistokehityksen elinkaaren ajalla
- Hanki tehokkaat työkalut
Yleiset turvallisuus- ja suorituskykyvaatimukset
Lääkintälaiteasetuksen liitteessä I esitetyt turvallisuus- ja suorituskykyvaatimukset korvaavat direktiivien olennaiset vaatimukset. Valmistajan on osoitettava noudattavansa näitä vaatimuksia riskienhallinnan, testauksen, teknisten tutkimusten sekä muiden keinojen kautta. Asetuksen ohjelmistokehitystä koskevia tärkeimpiä muutoksia ovat:
- Riskienhallinta
- Ohjelmoitavat elektroniset järjestelmät ja ohjelmistot
- Yhteensopivuuden suunnittelu
- Maallikoiden käyttöön tarkoitetut laitteet
Riskienhallinta, jota käsitellään lääkintälaiteasetuksen liitteessä I, on periaatteessa yhteenveto ISO 14971 -standardin vaatimuksista. Riskienhallintaa korostetaan myös standardissa ISO 13485:2016.
Ohjelmistojen osalta tietoturvan ja tietoverkkoturvallisuuden periaatteet ovat uusia painotusalueita lääkintälaiteasetuksessa. Valmistajien on asetettava vähimmäisvaatimukset laitteistoille, IT-verkon ominaisuuksille ja suojaustoimille sekä myös suojaus luvatonta käyttöä vastaan. Valmistajien tulee myös huomioida mobiilialustojen erityispiirteet (esim. näytön koko ja kontrastisuhde) sekä niiden käyttöön liittyvät ulkoiset tekijät (vaihteleva ympäristön valoisuus ja melutaso).
Laitteet, jotka on tarkoitettu käytettäväksi yhdessä muiden laitteiden tai tuotteiden kanssa, on suunniteltava ja valmistettava siten, että laitteet ovat luotettavia ja turvallisia yhteentoimivuuden ja -sopivuuden kannalta.
Maallikoiden (muiden kuin ammattikäyttäjien) käyttöön tarkoitetut laitteet on suunniteltava ja valmistettava siten, että ne toimivat käyttötarkoitustaan vastaavasti huomioiden maallikoiden käytettävissä olevat taidot ja keinot. Tietojen ja ohjeiden (esim. käyttöohje ja merkinnät) on oltava maallikolle helposti ymmärrettäviä ja sovellettavia.
Riskienhallinta
Riskienhallinta tarkoittaa hallintaperiaatteiden, -menettelyjen ja -käytäntöjen systemaattista soveltamista riskien analysointiin, arviointiin, torjuntaan ja valvontaan. Riskienhallintaa on suoritettava lääkinnällisen tuotteen koko elinkaaren ajan sekä myös tuotannonjälkeisessä vaiheessa. Ohjelmistojen riskienhallinta on liitettävä koko lääkinnällisen laitteen tai järjestelmän riskienhallintaan.
Riskienhallintaprosessi
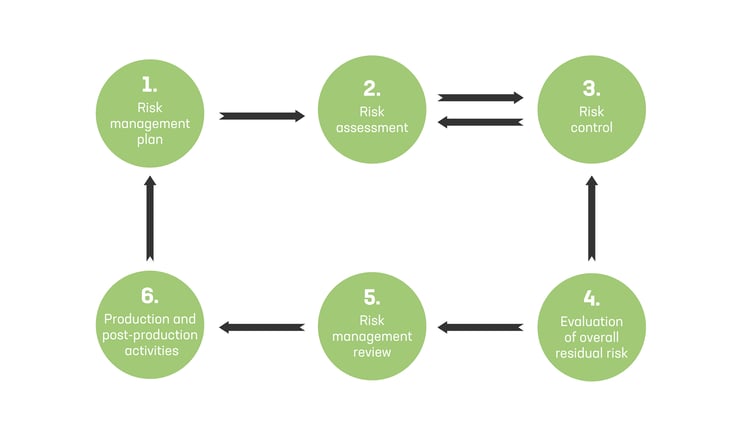
ISO 14971 -standardissa määritetään prosessivaiheet riskienhallintaan.
ISO 14971 -standardissa määritetään seuraavat prosessivaiheet lääkinnällisten laitteiden riskienhallintaan:
- Riskienhallintasuunnitelma (toimenpiteet, vastuut, riskin hyväksyttävyyskriteerit, tarkastustoimenpiteet jne.)
- Riskien arviointi (riskianalyysi ja arviointi)
- Riskien torjunta (mukaan lukien vaihtoehtoanalyysi, toimeenpano, jäännösriskin arviointi, riski-hyötyarvio, mahdollisten uusien riskien arviointi, riskien torjunnan kattavuuden tarkastus)
- Kokonaisjäännösriskin arviointi
- Riskienhallinnan katselmus (riskienhallintasuunnitelman toimeenpano)
- Tuotannon aikaiset ja jälkeiset toimenpiteet (sekä palaute riskienhallintasuunnitelmaan ja riskiarviointiin)
Kohdistaminen
Riskienhallinnan tulisi kohdistua ainakin seuraaviin:
- Kehitetyt ja ylläpidetyt (ohjelmisto)tuotteet
- Turvallisuus (tietoturva ja tietoverkkoturvallisuus)
- Riskeihin perustuva lähestymistapa laatujärjestelmäprosesseihin
- Projektien riskit, taloudelliset riskit ja liiketoiminnan suorituskykyyn liittyvät riskit.
Tuotteen riskienhallinnassa analysoidaan, arvioidaan ja torjutaan tuotteisiin liittyviä riskejä esimerkiksi toimivuuden, käytettävyyden ja suorituskyvyn osalta. Tämä voidaan integroida esimerkiksi suunnittelun katselmuksiin tai tarkastuksiin.
Turvallisuusriskien hallinta koskee riskianalyysin, riskiarvioinnin ja riskien torjunnan periaatteita sellaisia turvallisuusuhkia vastaan, jotka voisivat vaikuttaa lääkinnällisen laitteen (sisältäen sekä ohjelmistotuotteen että sen toimintaympäristön) tai sen käsittelemien tietojen luottamuksellisuuteen, eheyteen tai saatavuuteen ja sitä kautta mahdollisesti myös potilasturvallisuuteen. Turvallisuus tulee hallita tuotteen koko elinkaaren ajan seuraavien toimintojen avulla: tunnistaminen, suojaaminen, havaitseminen, reagointi ja palauttaminen.
Riskeihin perustuva lähestymistapa laatujärjestelmäprosessien valvonnassa luo perustan laatujärjestelmän sopivuuden, riittävyyden ja tehokkuuden säilyttämiseen ja parantamiseen. Painopiste ja priorisointi tulee asettaa prosesseihin, käytäntöihin ja ohjelmistoihin, joilla on suurin vaikutus lääkinnällisen laitteen turvallisuus- tai suorituskykyvaatimusten täyttymiseen tai sovellettavien viranomaismääräysten noudattamiseen.
ISO 14971 -standardi ei ota kantaa liiketoiminnan riskeihin. Siitä huolimatta projektien riskejä, taloudellisia riskejä tai liiketoiminnan suorituskykyyn liittyviä riskejä on hallittava liiketoiminnan suunnittelun kautta.
Riskien, niiden torjunnan sekä testauksen välinen jäljitettävyys tulee olla saatavilla.
Ohjelmistokehityksen elinkaari
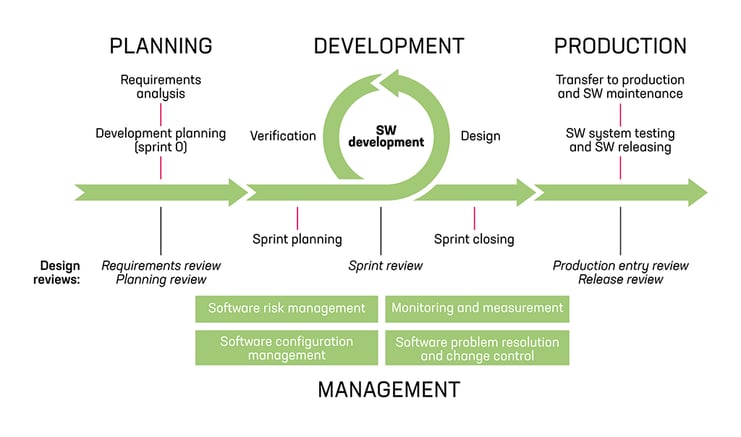
Esimerkki ohjelmistokehitysprosessin rakenteesta.
Lääkinnällisen laitteen ohjelmiston kehitysprosessin kulmakiven muodostavat ohjelmistokehityksen ja ylläpidon elinkaariprosessit, jotka on määritetty IEC 62304 –standardissa ja joita on tarkennettu ISO 14971 -standardissa riskienhallinnan osalta ja ISO 13485 -standardissa mm. asiakkaaseen liittyvien prosessien sekä suunnittelu- ja kehitysprosessien osalta. Ketteriä menetelmiä, kuten Scrum, voidaan integroida kehityssyklien ytimeen.
Ohjelmiston ylläpito toistaa kaikki alkuperäisessä kehitysprojektissa käytetyt olennaiset prosessit joko sellaisenaan tai ylläpitoprojektille erikseen määriteltyinä. Ohjelmiston tai palvelun markkinoiltapoistoon liittyvät käytännöt on määriteltävä harkittava heti kun se on tarkoituksenmukaista.
Ohjelmistojen turvallisuusluokitus
IEC 62304 -standardin soveltamisen ydin on ohjelmistojen turvallisuusluokitus (luokat A, B ja C). Potilasturvallisuus on kriittisen tärkeää, eikä sen varmistaminen testauksen kautta riitä. Ohjelmistojen turvallisuusluokitus määrittää turvallisuuteen liittyvät prosessit, joita on noudatettava koko kehityksen elinkaaren ajan vaatimusten määrittelystä ja suunnittelusta ohjelmiston julkaisuun ja ylläpitoon. Turvallisuuden sisällyttäminen prosesseihin varhaisessa vaiheessa säästää myöhemmin aikaa, vaivaa ja kustannuksia.
Ohjelmiston turvallisuusluokka määritetään arvioimalla ohjelmistojärjestelmän potentiaalisiin virheisiin liittyvät riskit sekä mahdollisten henkilövahinkojen vakavuusaste. Ohjelmiston turvallisuusluokkaa voidaan alentaa tunnistamalla ja toteuttamalla ulkoisia riskienhallintatoimenpiteitä esimerkiksi laitteiston tai toisen ohjelmiston kautta, jotta ohjelmistovirheet eivät aiheuta riskiä, joka ei ole hyväksyttävissä.
Huomaa, että ohjelmiston turvallisuusluokitus on eri asia kuin lääkinnällisen laitteen riskiluokitus, ja niitä käytetään eri tarkoituksiin. Edellisen avulla määritetään tarvittavat ohjelmistoprosessit, ja jälkimmäistä käytetään lääkinnällisen laitteen määräystenmukaisuuden varmistamiseen.
Suunnittelun katselmukset
Suunnittelun katselmukset yhdessä riskienhallinnan kanssa varmistavat, että tuote on turvallinen ja toimii käyttötarkoituksensa mukaisesti.
Suunnittelun katselmuksissa arvioidaan projektin edistyminen ja tuotteen riskit sen edetessä kehityksen läpi. Suunnittelun katselmusten apuna voidaan käyttää tarkistuslistoja kullekin vaiheelle. Esimerkiksi siirtäminen tuotantoon on vaihe, jossa ohjelmisto saatetaan markkinoille laitteena tai palveluna. Samanaikaisesti vastuu ohjelmistosta siirtyy kehitysprojektilta ylläpitoprojektille. Tämä siirto on vietävä läpi siihen liittyvän suunnittelun katselmuksen kautta.
Korjaavat ja ennaltaehkäisevät toimet (CAPA)
Korjaavien ja ennaltaehkäisevien toimien (Corrective and Preventive Action, CAPA) prosessissa tunnistetaan, ehkäistään ja poistetaan lääkinnällisten laitteiden ohjelmistotuotteisiin ja laatujärjestelmään liittyvän havaitun tai mahdollisen määräystenvastaisuuden syitä riskienhallinnan periaatteiden avulla. CAPA on kriittinen laatujärjestelmän prosessi, sillä siihen liittyy useita muita prosesseja.
CAPA-prosessin tyypillisiä haasteita:
- CAPA on lähes aina luonteeltaan toimintojen välinen, ja siihen liittyy monia ryhmiä ja toimintoja.
- Useimmat CAPA-toimenpiteet keskittyvät tyypillisesti pikemminkin ongelmien korjaamiseen kuin niiden ennaltaehkäisemiseen.
- CAPA-menetelmää käytetään liikaa tai liian vähän; menetelmä on säilytettävä prosessina, jonka avulla ratkotaan mahdollisia systeemisiä ongelmia.
- Ongelman kuvaus on harvoin varsinainen perimmäinen syy
- CAPA-prosessin huono määrittely
Tiedot ja jäljitettävyys
Riittävät ja luotettavat tiedot ovat olennaisia kehitys- ja markkinoille saattamisen jälkeisissä vaiheissa, esimerkiksi riskienhallinnassa.
Esimerkiksi tuotteeseen liittyvät asiakasreklamaatiot tai vaatimustenvastaisuudet on pystyttävä jäljittämään tiettyihin suunnitteluvaiheisiin.
Toinen merkittävä asia on jäljitettävyys, ei ainoastaan vaatimusten jäljittäminen toteutukseen ja testaukseen, vaan myös ihmisten, prosessien ja tietojen saumaton liittäminen koko arvoketjussa. Esimerkiksi tuotteeseen liittyvät asiakasreklamaatiot tai vaatimustenvastaisuudet on pystyttävä jäljittämään tiettyihin suunnitteluvaiheisiin. CAPA sitoo markkinoille saattamisen jälkeisen valvonnan (Post-Market Surveillance, PMS) prosessien tiedot suunnitteluun ja kehitykseen jäljitettävyyden ja riskienhallinnan avulla.
Lisäksi jäljitettävyyden on oltava kaksisuuntaista, esimerkiksi vaatimuksista testitapauksiin ja testitapauksista takaisin vaatimuksiin. Myös ilmoitettu laitos tarkastaa jäljitettävyyden auditoinneissa.
Työkalut
Työkaluilla on tärkeä merkitys ohjelmistokehitysprosesseissa. Yksi tärkeimmistä on työkalu versionhallintaan, konfiguraatioiden hallintaan, jatkuvaan integrointiin ja jatkuvaan jakeluun. Välttämättömiä ovat myös vaatimustenhallinnan, ketterien menetelmien ja riskienhallinnan työkalut. Kannattaa ehkä harkita myös tuote-elinkaarenhallintaan tarkoitettua työkalua jossa on otettu huomioon lääkintälaiteasetuksen ja ohjelmistoelinkaarenhallinnan vaatimukset.
Täydellistä vastaavuutta ISO 13485 -standardiin tai lääkintälaiteasetukseen voi olla haasteellista saada aikaan ohjelmistokehitysprosessissa pelkkien papereiden tai asiakirjojen tai taulukkolaskentaratkaisujen avulla. Työkalujen asianmukainen käyttö mahdollistaa myös jäljitettävyyden esim. muutostenhallintaa varten. Ohjelmistokehityksen elinkaaren aikana käytettävät työkalut ja ohjelmistosovellukset on validoitava ennen niiden ensimmäistä käyttöä sekä muutosten jälkeen tarpeen mukaan käyttöön liittyvän riskin perusteella.
Viitteet:
ISO 13485:2016
ISO 14971:2019
IEC 62304
Medical Device Regulation (EU) 2017/745
Guidance on Cybersecurity for medical devices (MDCG 2019-16)
Pinja Hyvinvointi- ja terveysteknologia, Laatujärjestelmä (sisäinen asiakirja)
Lue lisää
Lääkinnällisten laitteiden ohjelmistojen suunnittelu lääkintälaiteasetuksen (MDR) mukaisesti – Osa 1: ohjelmiston määrittely ja luokittelu
Lääkinnällisten laitteiden ohjelmistojen suunnittelu lääkintälaiteasetuksen (MDR) mukaisesti – Osa 2: Vaatimustenmukaisuuden arviointi, ohjelmistomoduulit ja muutosten vaikutus
Lääkinnällisten laitteiden ohjelmistojen suunnittelu lääkintälaiteasetuksen (MDR) mukaisesti – Osa 3: Laatujärjestelmä (QMS)
Opas: Medical Device Regulation and Software Development – Key points to consider
Evondos-menestystarina
Synoste-menestystarina
BioMediTech-menestystarina
Terveys- ja hyvinvointiteknologia

Juha Sippola
Työskentelen Pinjalla ohjelmistosuunnittelijan ja laatupäällikön tehtävissä terveys- ja hyvinvointiteknologian liiketoimintayksikössä. Olen erittäin kiinnostunut laatuasioista, ja minulla on yli 15 vuoden kokemus laatuun liittyvistä tehtävistä mobiililaitteiden ja terveysteknologian aloilta. Vapaa-ajalla harrastan urheilua, kuten hiihtämistä, pyöräilyä ja kuntosaliharjoittelua.
Takaisin kaikkiin blogeihi
Aihealueet
- Tuotannon Kehittäminen (70)
- Ura Pinjalla (69)
- Tiedolla Johtaminen (61)
- Valmistava Teollisuus (57)
- Kunnossapito (45)
- Ohjelmistokumppanuus ja Työkalut (44)
- Vastuullisuus (38)
- Metsäteollisuus (37)
- Bioenergia & Kierrätys (28)
- IT-tuki ja Ulkoistus (24)
- Verkkokauppa (23)
- Tekoäly ja Koneoppiminen (15)
- Julkinen Sektori (10)
- Säädösten Noudattaminen (1)